As pilhas convertem energia química em elétrica.
A pilha comum é formada de zinco (pólo negativo) e carbono (pólo positivo), em contato interno entre si por meio de uma mistura de dióxido de manganês, carbono, cloreto de zinco e amônio. Quando os pólos positivo e negativo são ligados externamente, ocorre uma reação química em que o zinco libera elétrons que atravessam o circuito externo.
O dióxido de manganês, em contato com o carbono, por sua vez, ‘consome’ elétrons. Essas transformações químicas produzem uma diferença de potencial elétrico, a voltagem, e conseqüentemente energia elétrica.
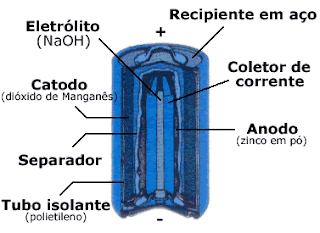
A pilha alcalina funciona de modo semelhante e ganhou esse nome devido a natureza básica de seu eletrólito, uma solução aquosa de hidróxido de sódio ou potássio, na qual se colocam eletrodos em dióxido de manganês e em pó de zinco. A reação entre esses três componentes é que gera a energia necessária e faz a pilha funcionar.
Uma pilha alcalina é constituída por um ânodo, um "prego" de aço envolto por zinco revestidos por uma camada de aço niquelado, um separador de papel e um isolante de nylon.
Comparando-as com as pilhas secas comuns, as alcalinas são mais caras, mantêm a voltagem constante por mais tempo e duram cinco vezes mais. Isso ocorre porque o hidróxido de sódio ou potássio é melhor condutor eletrolítico, e o meio básico faz com que o eletrodo de zinco sofra um desgaste mais lento comparado com as pilhas comuns que possuem um caráter ácido.


Nenhum comentário:
Postar um comentário